伪狂犬病病毒(PRV)是猪疱疹病毒科Alpha疱疹病毒亚家族的一员,是一种包膜双链DNA病毒。这种病毒是Aujeszky病的病原体,自然界中猪是PRV的主要宿主,在5日龄以内的仔猪中,PRV感染的死亡率约为100 %,对养猪业造成了沉重的损失。作为PRV的关键酶,dUTPase的功能是维持较低的细胞dUTP/dTTP比率,确保DNA复制的准确性,并通过催化dUTP水解成dUMP和焦磷酸盐来为dTTP提供dUMP前体,但其结构和酶催化机制尚不清晰。
2024年9月17日,宁夏大学徐金瑞、天津大学王亚鑫及叶升共同通讯在International Journal of Biological Macromolecules(一区TOP)上在线发表题为“Structural definition of pseudorabies virus dUTPase reveals a novel folding dimer in the herpesvirus family”的研究论文。

首先,团队通过X射线衍射解析了伪狂犬病毒dUTPase的2.23 Å高分辨晶体结构,阐明dUTPase以果冻卷基序形成的β桶二聚体的形式存在,两种单体的结构表现出高度的相似性,但在它们的二级结构中可以观察到细微的差异。利用静态光散射和小角衍射分析,证实了二聚体在溶液中的稳定性。同时根据其结构信息,在每个单体中存在一个空腔,根据空腔的结构及其与底物dUMP的相互作用,可以合理地将其视为PRV dUTP酶的活性中心(图1)。
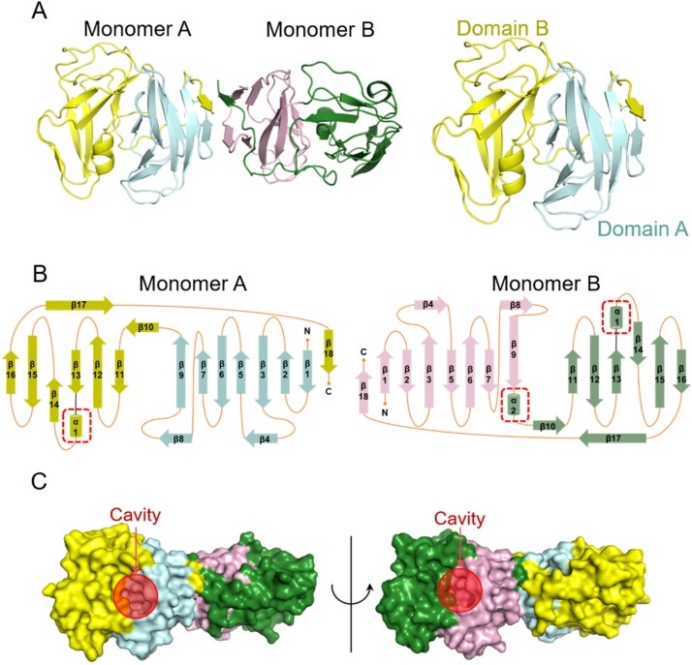
图1.伪狂犬病毒dUTPase的晶体结构。
在伪狂犬病毒和其他物种的dUTPase序列比对中,发现与三聚体dUTP酶相比,PRV dUTP酶没有表现出明显的保守基序。而在伪狂犬病毒和其他疱疹病毒的dUTPase序列比对中,发现这些dUTP酶之间的序列具有6个明显保守的基序。针对这些保守基序上的结合底物的关键氨基酸进行了突变,并检测dUTPase突变体的酶活性,G82A、V84A、F88A和Q93A突变体的酶活性不受明显影响,相反,I83A、D85A、D173A、R172A、S173A、S174A和Q214A突变体的酶活性显著降低(图2)。
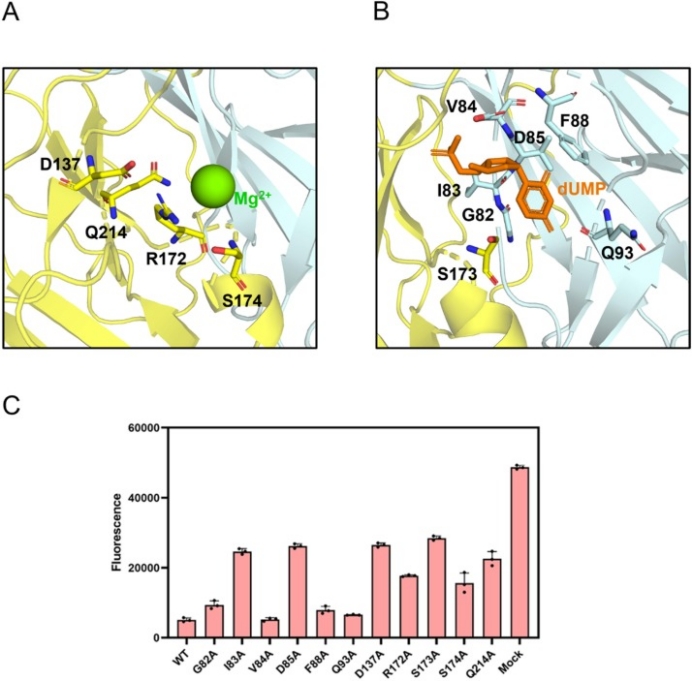
图2.突变体dUTPase酶活性测定。
与已发现的疱疹病毒家族中单体dUTPase不同,伪狂犬病毒dUTPase以稳定的二聚体形式存在。为了探究二聚体的寡聚状态对dUTPase的作用,团队对二聚体互作界面进行分析,发现与dUTP酶的经典二聚体状态(例如克氏锥虫和重型利什曼原虫)不同,它们利用α螺旋和非二级结构之间的相互作用缠结以构成二聚体界面,而PRV dUTP酶在很大程度上依赖于在四个β折叠片的N端残基P33-V36和C端残基R242-A248之间建立的氢键和疏水相互作用网络。破坏这些残基之间的氢键网络,对酶活性产生了很大影响,热迁移试验(TSA)还表明二聚体互作界面对蛋白稳定发挥了关键作用(图3)。
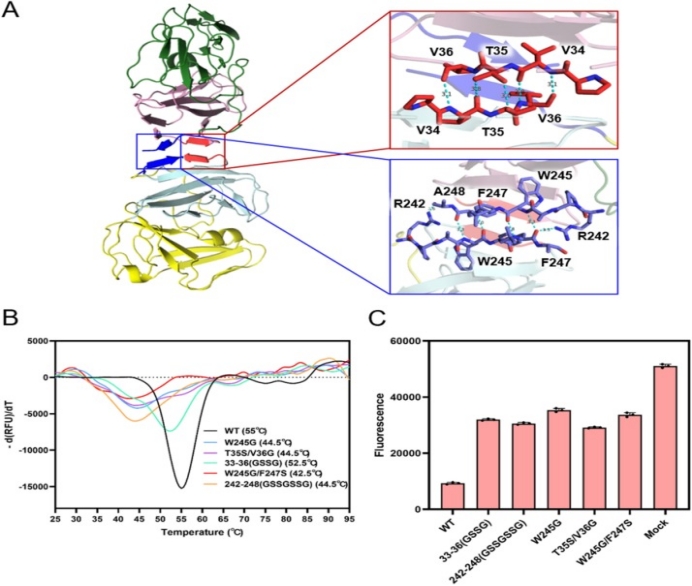
综上所述,该研究发现了疱疹病毒家族中一种全新的dUTPase结构,并为基于结构的药物开发提供了研究基础。该研究得到科技部重点研发计划、国家自然科学基金及西部特色生物资源保护与利用教育部重点实验室开放课题的资助。
文章链接:https://doi.org/10.1016/j.ijbiomac.2024.135696